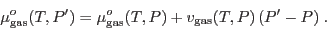Para poder hablar de las propiedades fisicoquimicas del agua, es necesario conocer,
que es el agua?:
Se piensa que el agua natural que conocemos es un compuesto químico de fórmula H2O, pero no es así. Debido a su gran capacidad disolvente, toda el agua que se encuentra en la naturaleza contiene diversas sustancias en solución y hasta en suspensión, lo que corresponde a una mezcla.
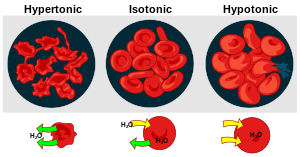
 s el principal e imprescindible componente del cuerpo humano. El ser humano no puede estar sin beberla más de cinco o seis días sin poner en peligro su vida. El cuerpo humano tiene un 75 % de agua al nacer y cerca del 60 % en la edad adulta. Aproximadamente el 60 % de este agua se encuentra en el interior de las células (agua intracelular). El resto (agua extracelular) es la que circula en la sangre y baña los tejidos.
s el principal e imprescindible componente del cuerpo humano. El ser humano no puede estar sin beberla más de cinco o seis días sin poner en peligro su vida. El cuerpo humano tiene un 75 % de agua al nacer y cerca del 60 % en la edad adulta. Aproximadamente el 60 % de este agua se encuentra en el interior de las células (agua intracelular). El resto (agua extracelular) es la que circula en la sangre y baña los tejidos.Molecula del agua:
Dos átomos de hidrógeno están unidos al átomo de oxígeno mediante un enlace
 covalente. Pero la molécula de agua no es lineal, de manera que las direcciones de los enlaces O-H forman entre sí un ángulo que se estima en 105º.
covalente. Pero la molécula de agua no es lineal, de manera que las direcciones de los enlaces O-H forman entre sí un ángulo que se estima en 105º. Las uniones hidrógeno-oxígeno son tales que cada hidrógeno comparte con el oxígeno un par de electrones. Pero como el oxígeno tiene más apetencia que el hidrógeno por ese par, la pareja de electrones  está algo más cerca del oxígeno, quedando este con una cierta carga negativa y algo más lejos del hidrógeno, que queda a su vez con cierta carga positiva. Se dice que es una molécula polar (que posee polos cargados eléctricamente).
está algo más cerca del oxígeno, quedando este con una cierta carga negativa y algo más lejos del hidrógeno, que queda a su vez con cierta carga positiva. Se dice que es una molécula polar (que posee polos cargados eléctricamente).
Ello hace que las moléculas de agua se atraigan entre sí, de forma que el extremo positivo donde se halla el hidrógeno de una molécula se acerque al extremo negativo de otra donde se halla el oxígeno.Ese enlace, conocido como enlace por puentes de hidrógeno, es intermolecular (entre moléculas) y es bastante más débil que el enlace covalente entre los componentes de la molécula. Sin embargo, es el causante de algunos comportamientos del agua.
 líquido inodoro e insípido. Tiene un cierto color azul cuando se concentra en grandes masas. A la presión atmosférica (760 mm de mercurio), el punto de fusión del agua pura es de 0ºC y el punto de ebullición es de 100ºC, cristaliza en el sistema hexagonal, llamándose nieve o hielo según se presente de forma esponjosa o compacta, se expande al congelarse, es decir aumenta de volumen, de ahí que la densidad del hielo sea menor que la del agua, alcanza su densidad máxima a una temperatura de 4ºC,que es de 1g/cc.
líquido inodoro e insípido. Tiene un cierto color azul cuando se concentra en grandes masas. A la presión atmosférica (760 mm de mercurio), el punto de fusión del agua pura es de 0ºC y el punto de ebullición es de 100ºC, cristaliza en el sistema hexagonal, llamándose nieve o hielo según se presente de forma esponjosa o compacta, se expande al congelarse, es decir aumenta de volumen, de ahí que la densidad del hielo sea menor que la del agua, alcanza su densidad máxima a una temperatura de 4ºC,que es de 1g/cc.
Su capacidad calorífica es superior a la de cualquier otro líquido o sólido, siendo su calor específico de 1 cal/g, esto significa que una masa de agua puede absorber o desprender grandes cantidades de calor, sin experimentar apenas cambios de temperatura, lo que tiene gran influencia en el clima (las grandes masas de agua de los océanos tardan más tiempo en calentarse y enfriarse que el suelo terrestre). Sus calores latentes de vaporización y de fusión (540 y 80 cal/g, respectivamente) son también excepcionalmente elevados.
Propiedades Quimicas del Agua:
Casi la totalida
 d de los procesos químicos que ocurren en la naturaleza, no solo en organismos vivos, sino también en la superficie no organizada de la tierra, así como los que se llevan a cabo en el laboratorio y en la industria, tienen lugar entre sustancias disueltas en agua, esto es en disolución. Normalmente se dice que el agua es el disolvente universal, puesto que todas las sustancias son de alguna manera solubles en ella, ya que o posee propiedades ácidas ni básicas, se combina con ciertas sales para formar hidratos, reacciona con los óxidos de metales formando ácidos y actúa como catalizador en muchas reacciones químicas.
d de los procesos químicos que ocurren en la naturaleza, no solo en organismos vivos, sino también en la superficie no organizada de la tierra, así como los que se llevan a cabo en el laboratorio y en la industria, tienen lugar entre sustancias disueltas en agua, esto es en disolución. Normalmente se dice que el agua es el disolvente universal, puesto que todas las sustancias son de alguna manera solubles en ella, ya que o posee propiedades ácidas ni básicas, se combina con ciertas sales para formar hidratos, reacciona con los óxidos de metales formando ácidos y actúa como catalizador en muchas reacciones químicas.
- http://www.agua.org.mx/content/category/4/14/43/
- http://www.aula21.net/Nutriweb/agua.htm
- http://platea.pntic.mec.es/iali/personal/agua/agua/propieda.htm
- http://mx.kalipedia.com/fisica-quimica/tema/molecula-agua.html?x1=20070924klpcnafyq_82.Kes